院長ブログ2016年1月
明けましておめでとうございます。
認知症の続きです。少し専門的になります。
治らない認知症のひとつPSP(進行性核上麻痺)について
PSPは神経細胞の微小管結合蛋白(microtubule-associated protein)のひとつであるtau蛋白が蓄積して神経細胞の機能不全を生じて発病する病気です。tau蛋白には6つのisoformがあり、microtubuleの結合部位の数によって3 repeats tauと 4 repeats tauとがあります。
4 repeats tau の模式図
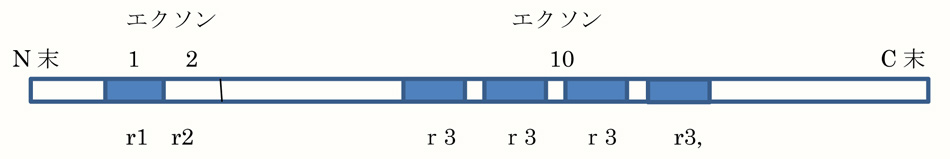







r1:29個のAA, r2:58個のAA, r3:C末端に31-32個のAAのリピート
PSPには4-repeats tauのみが蓄積している。tau蛋白は、「折り畳めていない」構造なのだが、神経細胞に蓄積する時には「異常な折り畳み構造」になっている封入体として蓄積する。狂牛病として知られているクロイツフェルト・ヤコブ病の病原物質であるプリオンに似ているので、プリオノイド蛋白(プリオン様蛋白)と呼ばれています。プリオノイド蛋白としては、Aβ、α―スヌクレイン、tau, SOD1, TDP43蛋白があります。共通している性質は、少量のすでに重合した蛋白を加えると、溶けていた可溶性の蛋白の速やかな凝集が進行することです。
Pick病はエクソン10の3-repeats tauが前頭側頭部に蓄積し、tauは381個あるいは410個のAAから成り立っています。
進行性核上性麻痺(PSP),大脳皮質基底核変性症(CBD)、嗜銀顆粒性認知症には、エクソン10の4-repats tauが蓄積しており、383個、412個、441個のAAから成り立っています。
胎児期にはMWが小さい352個のAAから成り立っているtauが存在しています。
アルツハイマー病(AD)、神経原線維変化型認知症には、エクソン10に3-repeats を有するtauと4-repeats tauが混在しています。
FTDP-17は変異部位によって異なっています。
Tau蛋白は、神経細胞とグリア細胞にあり、微小管の安定化を調整し、特に神経細胞の極性や軸索を確立する役割を有しています。Tau蛋白のN末端の突出部位が脂質ラフトに結合した非受容体性チロシンキナーゼと相互作用して、軸索の伸長、誘導、髄鞘化に一定の役割を果たす。
Repeat(r3等)はC末端に31-32個のAAからなる繰り返し配列があり、リピート領域と呼ばれています。

